4月26日,复旦大学基础医学院医学分子病毒重点实验室袁正宏研究组与北京大学邓宏魁研究组、解放军总医院卢实春研究组合作在《科学》(Science)杂志发表了题为《原代人肝脏细胞在体外的长期功能性维持》(Long-term functional maintenance of primary human hepatocytes in vitro)的研究论文,首次证明利用化学小分子调控细胞信号通路,实现了功能肝细胞在体外的长期维持,并证实此肝细胞在体外支持乙型肝炎病毒(HBV)及丙型肝炎病毒(HCV)的长期持续感染。该工作为大量制备功能成熟肝细胞及其应用提供了可能。
如何诱导获得功能成熟的细胞并在体外保持其功能性是再生医学的关键瓶颈。在个体发育过程中,多种发育信号的精确调控,分化产生功能各异的细胞并长期稳定地维持其生理功能。然而,这些功能细胞一旦离开体内微环境便会迅速去分化并失去功能。此外, 由于缺乏适当的培养条件与微环境,体外源于干细胞诱导分化所获得的功能细胞,很难真正成熟并长期维持其功能,是再生医学研究和应用中长期面临的挑战。在过去的几十年里,人们尝试了改变培养材料,共培养以及三维培养等很多方法,但始终未能建立一个简单高效,稳定的功能细胞体外培养体系。
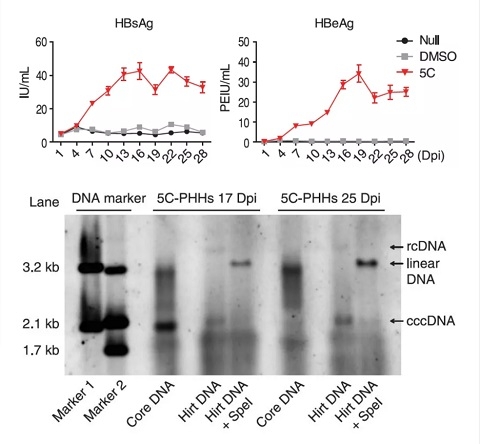
为解决这一问题,合作组以体外培养过程中快速失去功能的人原代肝细胞为研究对象,筛选到5种化学小分子的组合(5 compounds,5C)并利用它们在体外成功实现了肝细胞功能的长期维持。相比于传统遗传学方法,化学小分子能够实现对多个信号通路靶点的精细调控。在长达一个月以上的培养过程中,该培养方法成功抑制了肝细胞的去分化,细胞整体表达谱与体内的肝细胞高度相似,并可长期维持白蛋白分泌、尿素合成、药物代谢等肝细胞的功能。更重要的是,合作组通过一系列实验证明,5C培养的原代肝细胞可支持HBV及HCV,这两种具有严格肝噬性病毒的复制。在长达30天的感染过程中,乙肝表面抗原、e抗原、乙肝病毒DNA等指标明显优于目前常用的培养条件,尤其是能够长期稳定产生乙肝病毒复制必需的cccDNA(共价闭合环状DNA)。在HCV感染方面,5C培养的原代肝细胞中也检测到了丙型肝炎病毒有效复制的信号,而这在普通原代肝细胞培养条件下是检测不到的。肝炎病毒的体外复制模型由于缺乏有效的模拟体内肝脏细胞的模型一直是病毒学领域的难点。基于5C的细胞模型对于进一步开展HBV,HCV及其他肝炎病毒的基础研究及药物研发具有重要意义。
北京大学邓宏魁教授,解放军总医院卢实春教授以及复旦大学袁正宏教授为该论文的共同通讯作者,向晨罡博士、杜媛媛博士以及孟高帆博士为该论文的共同第一作者。复旦大学基础医学院易志刚副教授、研究生舒君、上海市公共卫生临床中心张小楠研究员,助研邬敏博士在病毒感染和检测方面提供了全面的支撑。本工作获得了国家重点研发计划、国家自然科学基金和上海市教委科研创新计划等基金的大力支持。
中国工程院院士闻玉梅认为该篇论文是我国学者研究乙肝、丙肝以及其他肝脏疾病的机理的一项重大突破。作者们通过用FSK, SB431542, DAPT, IWP2及LDN193189五种化合物,成功地实现了在体外将人肝细胞延长培养至4周。 用此技术体外培养的肝细胞,不仅保持了肝细胞的生理功能,最有意义的是,这些在体外维持数周的肝细胞可成功地被乙肝病毒感染,表达HBsAg与HBeAg。通过对比,发现乙肝病毒与丙肝病毒感染过程有较大不同。这一研究最重要的价值是细胞被乙肝病毒感染后,可以完成整个病毒复制周期, 包括产生共价闭合环状DNA(cccDNA);而 cccDNA正是目前乙肝病毒难以被清除,疾病难以被治愈的关键。通过这一平台,将可更深入提出解决cccDNA的策略。作者们还在这一平台上,对现有临床实用的抗乙肝病毒核苷类药物与干扰素进行了考核,证实了核苷类药物可抑制经细胞培养的乙肝病毒,经干扰素处理后细胞可上调干扰素激活的基因控制乙肝病毒。用此建立了较长期的人肝细胞体外培养平台,不仅将为研究乙肝治愈推进一大步,还提供了创新性研发抗肝炎病毒药物的重要工具。


